Come ti faccio crescere nuovo tessuto osseo
MIT ingegneri sviluppano ponteggi tessuti rivestiti
che aiutano stimolare una nuova crescita ossea
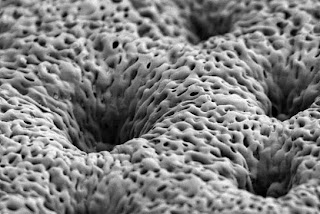
Nella
foto è una micrografia elettronica a scansione di un membrana porosa, poli
nanostrutturati (acido lattico-co-glicolico) (PLGA) membrana. La membrana è rivestita con un
rivestimento multistrato polielettrolita (PEM) che rilascia fattori di crescita
per promuovere la riparazione ossea.
Ingegneri
chimici del MIT hanno sviluppato ponteggi di tessuti rivestiti che aiutano il
corpo a fare crescere nuovo tessuto osseo per riparare lesioni o difetti
congeniti.
Ingegneri
chimici del MIT hanno messo a punto una nuova impalcatura di tessuto
impiantabile rivestito con fattori di crescita ossea che vengono rilasciati
lentamente nell'arco di alcune settimane. Quando viene applicato a lesioni ossee o a difetti congeniti, questa impalcatura
rivestita induce il corpo a formare rapidamente nuovo tessuto osseo che sembra
e si comporta proprio come il tessuto originale.
Questo
tipo di ponteggio rivestito potrebbe offrire un notevole miglioramento rispetto
l'attuale standard per il trattamento di lesioni ossee, che implica il
trapianto di midollo da un'altra parte del corpo del paziente - un processo
doloroso che non fornisce sempre abbastanza osso. I pazienti con lesioni ossee gravi, come i soldati feriti in
battaglia; persone che soffrono di difetti ossei
congeniti, come i disturbi cranio-maxillo-facciali; e pazienti che necessitano di aumento dell'osso prima
all'inserimento di impianti dentali possono beneficiare della nuova impalcatura
del tessuto.
"E
'stato un problema veramente difficile, e abbiamo cercato di fornire un
modo per affrontare questo problema,- dice Nisarg Shah, autore principale dello studio, che appare
negli Atti della National Academy of Sciences.
Paula
Hammond, David H. Koch in Ingegneria e un membro di Koch Institute del MIT for
Integrative Cancer Research e del Dipartimento di Ingegneria Chimica, sono gli
autori principali. Altri autori sono M. Nasim Hyder e Mohiuddin Quadir, studente
laureato Noémie-Manuelle Dorval Courchesne, Howard Seeherman di Restituo, Myron
Nevins della Harvard School of Dental Medicine, e Myron Spector di Brigham and
Women Hospital.
Stimolare la
crescita delle ossa
Due dei
più importanti fattori di crescita ossea sono un fattore di crescita derivati dalle
piastrine (PDGF) e una proteina
morfogenetica 2 (BMP-2). Come parte del sistema naturale
cicatrizzante, PDGF è uno dei primi
fattori rilasciati immediatamente dopo una lesione ossea, come una frattura. Dopo la visualizzazione PDGF,
altri fattori, tra cui BMP-2,
contribuiscono a creare l'ambiente giusto per la rigenerazione ossea reclutando
cellule in grado di produrre l'osso e la formazione di una struttura di
supporto, tra cui i vasi sanguigni.
Gli
sforzi per trattare lesioni ossee con questi fattori di crescita sono stati
ostacolati dalla incapacità di fornirli efficacemente e in modo controllato. Quando grandi quantità di
fattori di crescita sono consegnati troppo rapidamente, vengono rapidamente
eliminati dal sito di trattamento - così hanno ridotto impatto sulla
riparazione dei tessuti, e possono anche indurre effetti collaterali
indesiderati.
"Il
fattore di crescita deve essere rilasciato molto lentamente e con nanogrammi o
microgrammi come quantità, non in quantità di milligrammi , -dice Hammond-
meccanismo necessario per reclutare cellule staminali adulte native che abbiamo
nel nostro midollo osseoche vanno al sito di lesione e generano osso
intorno alla lesione o alla carenza congenita, e inoltre generano un sistema vascolare che si affianchi a questa rigenerazione."
E’ un
processo che richiede tempo, quindi i fattori di crescita debbono essere rilasciati lentamente nell'arco di diversi giorni o settimane. Per questo obiettivo, il team
del MIT ha creato una impalcatura molto sottile,porosa come un foglio rivestito, con
strati di PDGF e BMP. Utilizzando una tecnica di assemblaggio chiamata layer-by-layer , il foglio viene rivestito con circa 40 strati di BMP-2; e inoltre vi sono altri 40
strati di PDGF. Questo ha permesso al PDGF
di essere rilasciato più velocemente, con un più sostenuto rilascio anche di BMP-2,
mimando gli aspetti di una guarigione naturale.
"E'un grande vantaggio per l'ingegneria dei tessuti delle ossa-dice Nicholas Kotov, professore di ingegneria chimica all'Università del Michigan- dove il
rilascio delle proteine di segnalazione deve essere lento e programmato. Il
foglio scaffold è circa 0,1 millimetri di spessore; una volta che vengono applicati
i rivestimenti del fattore di crescita , i ponteggi possono essere tagliati dal
foglio on demand, e nelle dimensioni adeguate per l'impianto in una lesione
ossea o in un difetto.
Riparazione
efficace
I
ricercatori hanno testato ratti con un difetto del cranio abbastanza grande
- 8 millimetri di diametro - che non poteva guarire da solo. Dopo che l’hanno impiantato, i
fattori di crescita sono stati rilasciati a velocità diverse. PDGF, rilasciato durante i primi giorni dopo l'impianto, aiutò ad avviare
la guarigione e a mobilitare diverse cellule precursori, al sito della ferita. Queste cellule sono responsabili per la formazione di nuovo
tessuto, tra cui i vasi sanguigni, strutture vascolari di supporto, e l'osso.
BMP,
rilasciato più lentamente, venne indotto ad alcune di queste cellule immature
per diventare osteoblasti, che
producono osso. Quando entrambi i fattori di
crescita sono stati usati insieme, queste cellule hanno generato uno strato di
osso. Due settimane dopo l'intervento, -dicono i ricercatori- era
indistinguibile da osso naturale nel suo aspetto e nelle proprietà meccaniche.
"Questa
combinazione ci permette non solo di aver accelerato la proliferazione prima,
ma anche di facilitare la produzione di tessuto vascolare, che prevede un
percorso sia per le cellule staminali e le cellule osteoblasti precursori e gli altri componenti a fare il loro
lavoro. Si finisce -dice Hammond -con
un sistema uniforme".
Un
altro vantaggio di questo approccio è che l'impalcatura è biodegradabile e si rompe
all'interno del corpo in poche settimane. Il materiale scaffold, fatto di un polimero chiamato PLGA, è ampiamente utilizzato nel trattamento medico e può essere
regolato a disintegrarsi ad una velocità specifica in modo che i ricercatori
possono progettare che debba durare solo per il tempo necessario.
La
squadra di Hammond ha depositato un brevetto sulla base di questo lavoro e ora
si propone di iniziare a testare il sistema in animali più grandi, nella
speranza di spostarlo eventualmente in studi clinici.


Commenti
Posta un commento